Propiedades de los períodos y de los grupos. Electronegatividad
|
Propiedades de los períodos y de los grupos. Electronegatividad |
Reactividad de metales y no metales
Las propiedades químicas de los elementos tienen una relación muy estrecha con la colocación de los mismos en la tabla periódica:
Las propiedades son muy similares para los elementos del mismo grupo.
Las propiedades varían a lo largo del período para volverse a repetir en el siguiente período.
La relación entre la variación de las propiedades y la situación en la tabla periódica está relacionada con la configuración electrónica de los elementos.
Para que puedas comprender a que nos referimos debes realizar la actividad titulada "Periodicidad y configuración electrónica". Cuando la hayas realizado podrás comprender que lo importante de la configuración electrónica son los denominados electrones de valencia.
Los electrones de valencia son los de la última capa (electrones 's' y 'p'); también son de interés químico los electrones de los subniveles 'd' / 'f' que se encuentran incompletos.
Las propiedades están en relación con la capacidad de perder, ganar o compartir electrones los átomos para que su configuración electrónica se parezca a la del gas noble más cercano.
La medida del tamaño del átomo se lleva acabo mediante la determinación de su radio.
El tamaño depende de dos factores:
- La atracción entre la carga positiva del núcleo y la negativa de la corteza.
A menor distancia mayor será la fuerza.
Para la misma distancia, si aumentan las cargas mayor será la fuerza de atracción.
- La repulsión entre las cargas negativas de los electrones y el aumento del número de capas.
Al aumentar el número de capas en un grupo, el aumento del número de protones del núcleo y de electrones de la corteza (aumento de la fuerza de atracción entre cargas opuestas), no compensa el aumento de la distancia. Por tanto, el aumento del número de capas disminuye la fuerza de atracción de los electrones más externos. Por otro lado, las últimas capas estarán más lejos del núcleo.
En un período la distancia entre los electrones más externos y el núcleo se mantiene en términos globales. Cada protón que introducimos en el núcleo al pasar a otro elemento del mismo período, aumenta la fuerza de atracción. Por otro lado, cada electrón que introducimos al pasar a otro elemento del mismo período, aumenta la fuerza de repulsión entre electrones. Salvo pequeñas variaciones, en un período es mayor la fuerza de atracción que de repulsión.
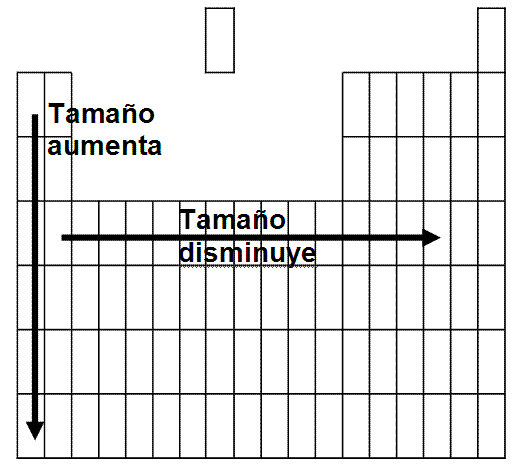
En resumen, el radio atómico varía de la siguiente forma:
En un grupo el tamaño aumenta a medida que bajamos en el mismo (mayor número atómico). Cuanto más abajo más lejos se encontrarán los electrones, la última capa estará más lejos del núcleo. Mayor distancia entre cargas positivas y negativas significa menor fuerza de atracción y, por tanto, mayor tamaño.
En un período disminuye por lo general el tamaño a medida que avanzamos en el mismo (mayor número atómico). Los electrones nuevos de cada elemento se ponen en la misma capa, a la misma distancia del núcleo. La fuerza de atracción entre el núcleo (mayor número de cargas positivas a medida que avanzamos en el período) y la capa de electrones aumenta dado que la distancia es la misma pero las cargas son mayores. Mayor fuerza de atracción implica menor tamaño, se acerca la capa de electrones al núcleo.
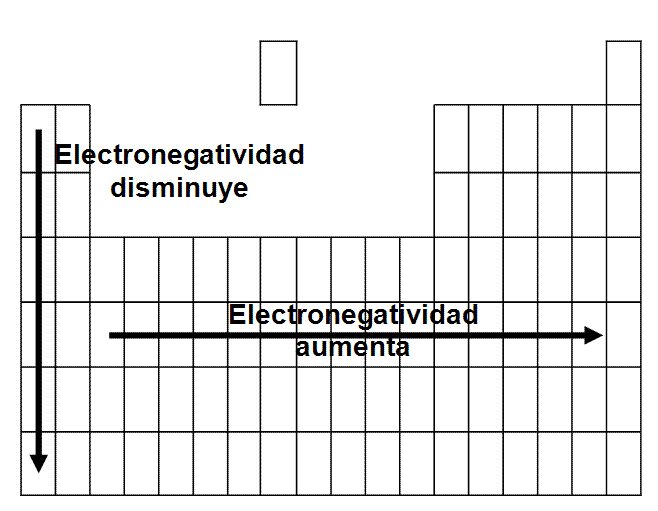
La electronegatividad mide la tendencia de un átomo para
atraer la nube electrónica hacia sí durante el enlace con otro átomo. La escala
de Pauling es un método ampliamente usado para ordenar los elementos químicos de
acuerdo con su electronegatividad, desarrolló esta escala en 1932.
Los valores de electronegatividad no están calculados, ni basados en formulas
matemáticas ni medidas. Pauling le dio un valor de 4,0 al elemento con la
electronegatividad más alta posible, el flúor. Al francio, el elemento con la
electronegatividad más baja posible, se le dio un valor de 0,7. A todos los
elementos restantes se les dio un valor entre estos dos extremos.
En un grupo la tendencia a perder electrones aumenta a medida que bajamos en el grupo. Los electrones estarán más lejos del núcleo cuanto más abajo nos encontremos en el grupo, resultará más fácil que los pierda y más difícil que los gane. La electronegatividad disminuye al bajar en el grupo.
En un período la tendencia a perder electrones disminuye a medida que avanzamos en el período, los electrones se encuentran más unidos al núcleo (ver lo que se explicaba para el tamaño). Por tanto, a medida que avanzamos aumentará la tendencia coger electrones más que a perderlos, aumentará la electronegatividad.
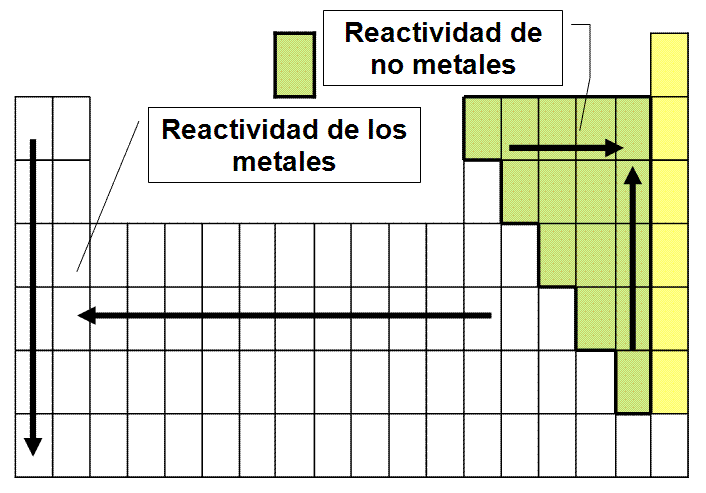
Reactividad de metales y no metales (ver regla del octeto)
Como dijimos anteriormente los elementos tienen tendencia a parecerse a los gases nobles más cercanos en cuanto a su configuración electrónica de la última capa. Los menos electronegativos tendrán tendencia a perder electrones frente a otros más electronegativos.
La reactividad de un elemento mide la tendencia a combinarse con otros.
Variación de la reactividad en los períodos. Son más reactivos los grupos de la izquierda que los de la derecha dado que resulta más fácil perder un electrón de la última capa que dos, tres,... Cuando llegamos a cierto grupo la tendencia se invierte dado que resultará más fácil ganar los electrones que le faltan para parecerse al gas noble más cercano. Por tanto, en un período
La reactividad de los metales aumenta cuanto más a la izquierda en el período (menos electrones a quitar).
La reactividad de los no metales aumenta al avanzar en el período (menos electrones a coger).
Variación de la reactividad en los grupos. A medida que descendemos en un grupo, los electrones de la última capa se encuentran más lejos del núcleo y, por tanto, resultará más fácil quitárselos y, en el caso de los no metales, más difícil el coger electrones.
La reactividad de los metales aumenta al avanzar en un grupo (mayor tendencia a perder electrones).
La reactividad de los no metales aumenta cuanto más arriba en el grupo (mayor tendencia a coger electrones)
En la formación de compuestos existe una tendencia a coger, perder o compartir electrones entre los átomos y de esta forma parecerse a la configuración electrónica del gas noble más cercano (ocho electrones en la última capa salvo el helio que sólo tiene dos). Esta tendencia se denomina 'Regla del octeto'.
La regla del octeto permite explicar que los metales adquieren la configuración de gas noble perdiendo electrones mientras que los no metales la adquieren compartiéndolos.
|
Pedro Martínez /
www.educamix.com /
educamix@telefonica.net
|