Disoluciones. Solubilidad.
|
Disoluciones. Solubilidad. |
Las disoluciones y la teoría cinético molecular
Concentración de una disolución:
Las disoluciones y la teoría cinético molecular.
Durante el proceso de disolución se produce un reajuste entre las sustancias que forman los componentes de la mezcla homogénea:
Si el soluto es un sólido, se rompe la estructura rígida del mismo por la atracción de las partículas del disolvente.
una vez disgregadas las partículas del sólido se integran en los huecos de las del disolvente.
Si el soluto es gas o líquido, la disolución es más fácil dado que no hay que disgregar ninguna estructura rígida.
Al integrarse las partículas del soluto en huecos de las del disolvente, el volumen final de la disolución no será la suma de los volúmenes individuales.
Por definición las disoluciones son mezclas homogéneas en las que no es posible distinguir las partículas de los componentes. Las disoluciones verdaderas son aquellas en las que los componentes son de magnitud molecular. Se consideran verdaderas aquellas en las que el tamaño de las partículas que las componen son inferiores a un nanómetro (109 m).
Las disoluciones se pueden clasificar de forma cualitativa en función de la relación entre soluto y disolvente:
Disoluciones diluidas: Cuando la cantidad de soluto de la disolución es muy pequeña.
Disoluciones concentradas: Cuando la cantidad de soluto de la disolución es muy elevada aunque todavía puede disolverse más soluto.
Disoluciones saturadas: Cuando en la disolución se ha llegado al máximo de soluto que pueda admitir. Si echamos más soluto no se disolverá.
Disolución sobresaturada: Cuando en la disolución hay más soluto del que admite la misma a dicha temperatura, tiene más soluto disuelto que en la disolución saturada. Se consigue evaporando disolvente o bajando la temperatura (baja la solubilidad), en dichas condiciones se alcanza la saturación llegando a sobrepasarla. Es una situación inestable en la que el más ligero movimiento hará precipitar el soluto sobrante
Normalmente los conceptos de disolución diluida y concentrada se usan para realizar comparaciones entre dos disoluciones: La disolución A es más concentrada que la B, o la disolución B es más diluida que la A.
Concentración de una disolución.
La concentración de una disolución expresa de forma numérica la proporción entre el soluto y el disolvente de una disolución.
La proporción se expresa de diversas formas: gramos / litro de disolución; tanto por ciento en peso, molaridad, molalidad, normalidad, fracción molar, etc. Nos vamos a quedar con las dos primeras formas.
Gramos por litro de disolución. Expresa la cantidad de soluto en gramos dividido por el número de litros de la disolución:

Ejemplo 1. Hay que preparar un litro de una disolución de 20 g / l de sal en agua. ¿Cómo se hace?
Pesar 20 g de sal
Disolver en un poco de agua (sin llegar al litro).
Una vez disuelta se debe seguir echando agua hasta que el volumen total de la disolución sea de 1 l. Ojo, no echamos un litro de agua, echamos agua hasta completar un litro de disolución.
Ejemplo 2. ¿Cómo preparar 2,5 litros de una disolución de 10 g/l de sal en agua?
Primero calculamos la cantidad de soluto necesaria:
Se pesan 25 g de la sal.
Se disuelven en agua (sin llegar al volumen total del enunciado).
Una vez disuelta se debe seguir echando agua (disolvente) hasta que la disolución alcance el volumen total pedido en el enunciado (2,5 litros).
Tanto por ciento en peso. Expresa el número de gramos de soluto contenidos en 100 gramos de disolución:
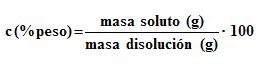
Teniendo en cuenta que la masa de la disolución es la suma de la masa de soluto más la de disolvente (ojo las masas sí se suman, no los volúmenes), la fórmula anterior quedaría de esta forma:
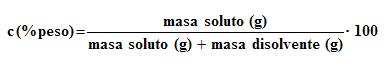
Ejemplo 1. Se quieren preparar 100 g de una disolución del 5% en peso de sal en agua. ¿Cómo se hace?
Primero debemos calcular la cantidad de soluto (sal) que debemos pesar.

Se pesan 5 g de la sal.
Se disuelven en agua (sin llegar al total de la masa de disolución del enunciado).
Una vez disuelta se debe seguir echando agua (disolvente) hasta que la disolución alcance la masa total de 100 g.
Ejemplo 2. Disolvemos 20 g de sal en 180 g de agua. ¿Cuál es su concentración en tanto por ciento en peso?
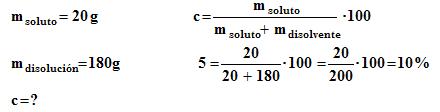
Solubilidad en agua y temperatura.
La solubilidad es la concentración de la disolución saturada. Depende de varios factores, entre ellos de la temperatura y se suele expresar en gramos del soluto por cada 100 cm3 de disolvente. Si la queremos expresar en g soluto / l de disolvente deberemos multiplicar la anterior por diez.
La solubilidad de casi todas las sustancias sólidas en líquidos, aumenta con la temperatura. La influencia de la temperatura en la solubilidad se refleja en las curvas de solubilidad.
Las curvas de solubilidad representan la concentración a la que el soluto se encuentra saturado. Se representa en el eje de abscisas (eje de las X) la temperatura, y en el eje de ordenadas (eje de las Y) la solubilidad (concentración en gramos de soluto por cada 100 cm3 de agua o concentración en gramos de soluto por litro de disolvente).
Los gases disminuyen su solubilidad en los líquidos al aumentar la temperatura.
|
Pedro Martínez /
www.educamix.com /
educamix@telefonica.net
|