Configuración electrónica. Números cuánticos.
Definiciones
|
Configuración electrónica. Números cuánticos. Definiciones |
Como sabes en la corteza atómica se encuentran los electrones moviéndose alrededor del núcleo atómico.
Los electrones se encuentran en la corteza en diferentes capas o niveles. En cada capa o nivel se puede situar un número máximo de electrones que viene dado por la expresión: nº electrones = 2·n2, donde n es el número de orden de la capa o nivel.
A su vez, los electrones se encuentran en cada nivel distribuidos en diferentes subniveles denominados con las letras s, p d, f, etc. El número de electrones que cabe en cada subnivel es el siguiente:
|
Subnivel |
Número de electrones que puede haber como máximo |
|
s |
2 |
|
p |
6 |
|
d |
10 |
|
f |
14 |
El tipo de subnivel que puede tener un nivel dado depende del número de electrones máximo del mismo:
|
Nivel (n) |
Número máximo de electrones que se pueden poner (2·n2) |
Subniveles que tiene |
|
1 |
2·12 = 2·1 = 2 |
s |
|
2 |
2·22=2·4=8 |
s p |
|
3
|
2·32=2·9=18 |
s p d |
|
4 |
2·42=2·16=32 |
s p d f |
Para tener una idea muy aproximada de la distribución de los electrones en los diferentes niveles y subniveles se utiliza el diagrama de Möller. Este diagrama indica el orden de llenado de los subniveles y niveles de energía de un átomo, de arriba hacia abajo, siguiendo el sentido de las flechas, hasta llegar al número de electrones que tiene dicho átomo.
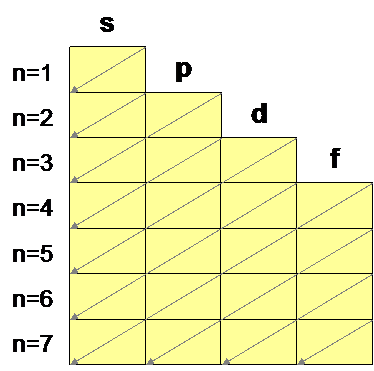
Ejemplo. Escribe la estructura electrónica (distribución de electrones en la corteza) del elemento Ho (Z = 67).
El número de protones coincide con el número atómico, es decir tendrá 67 protones. En el átomo neutro habrá tantos protones como electrones: nº e- = 67. Dibujando el diagrama de Möller, se van cubriendo los huecos hasta alcanzar el número de 67 electrones.
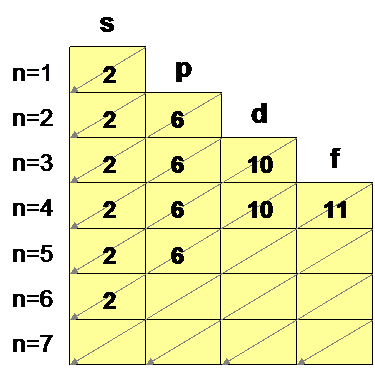
La configuración electrónica es:
1 s2 2 s2 p6 3 s2 p6 d10 4 s2 p6 d10 5 s2 p6 6 s2 4 f11
El subnivel que se está llenando se debe poner al final, en nuestro ejemplo 4 f11.
En química resulta de importancia los electrones más lejanos al núcleo:
- Electrones de los subniveles ‘s’ y / o ‘p’ del último subnivel.
- Electrones de los subniveles ‘d’ o ‘f’ que estén incompletos.
En nuestro ejemplo los electrones que resultan de interés en química serían 6 s2 4 f11 al ser lo que están más lejos del núcleo, resultando más fácil que intervengan en las reacciones químicas habituales.
El resto de los electrones se encuentran en niveles / subniveles más unidos al núcleo, resultando más difícil extraerlos / moverlos a otros nivel en las reacciones químicas habituales.
Para aclarar más la forma de utilizar el diagrama: acceso a la simulación
Como hemos dicho anteriormente, los electrones sólo pueden estar en determinadas órbitas alrededor del núcleo atómico, el resto de las posiciones está restringido al electrón. Cada una de dichas restricciones viene dada por un concepto que denominamos número cuántico. En tercero de la ESO sólo vemos dos restricciones de las cuatro que hay:
- La distancia al núcleo nos da el nivel de energía en el que se encuentra el electrón (lo que hemos denominado n), se denomina número cuántico principal.
La forma de la órbita es otro tipo de restricción (lo que hemos denominado subnivel de energía que viene dado por las letras, s, p, d, f,…), se denomina número cuántico secundario.
|
Pedro Martínez /
www.educamix.com /
educamix@telefonica.net
|