
Masa molecular. Porcentaje en peso de cada elemento en un compuesto.
 |
Masa molecular. Porcentaje en peso de cada elemento en un compuesto. |
Composición porcentual a partir de la fórmula
La masa molecular es la suma de las masas atómicas (en 'uma' o simplemente 'u') en una molécula. En algunos textos todavía se denomina como 'peso molecular' a la 'masa molecular'.
Para calcularla debemos saber las masas atómicas de cada uno de los elementos que intervienen en el compuesto.
Empezaremos por uno de los lados de la fórmula, por ejemplo el izquierdo.
Multiplicaremos el subíndice del elemento (cuando no existe se asume que es 1) por la masa atómica del mismo.
Procederemos de la misma forma con todos los elementos.
Sumaremos los resultados de todas las multiplicaciones y de esta forma tendremos la masa molecular expresada en unidades de masa atómica ('uma' o 'u').
Ejemplo de cálculo de masas moleculares en formato flash (puede tardar un poco en abrirse)
Otros ejemplos:
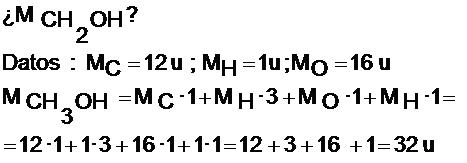
Si la fórmula tiene un paréntesis, multiplicaremos cada uno de los subíndices que se encuentren dentro del paréntesis por el número que viene como subíndice del paréntesis.
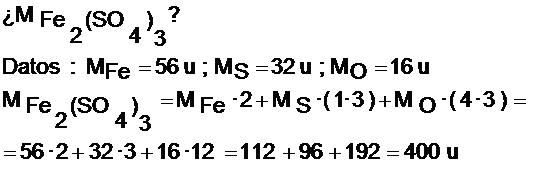
Composición porcentual a partir de la fórmula.
El porcentaje en peso de cada uno de los elementos en un compuesto siempre debe ser el mismo, independientemente de la cantidad de compuesto que tengamos; es decir, si un compuesto orgánico tiene un 40% en peso del elemento carbono (C), lo tendrá tengamos un gramo o una tonelada de dicho compuesto: el 40% de esa cantidad será carbono.
¿Cómo se calcula la composición porcentual? Para contestar la pregunta utilizaremos un ejemplo. Calculemos el porcentaje en peso de los elementos que hay en el SO3 (MS = 32 u ; MO = 16 u).
Calcularemos la masa molecular del compuesto:
![]()
Calculamos el número de unidades de masa atómica del primer elemento de la fórmula (masa atómica multiplicada por el número de átomos que hay de dicho elemento en la fórmula. Dicho número lo dividimos por la masa molecular (masa de todo el compuesto en unidades de masa atómica) y el resultado se multiplica por cien. Fíjate que el cociente debe ser inferior a la unidad dado que la masa de cada elemento en la fórmula debe ser inferior al total (hay otros elementos). Al multiplicar un cociente inferior a la unidad por cien el resultado será inferior a cien. Si es necesario se suele redondear el porcentaje a un decimal.
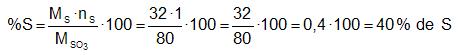
donde nS es el número de átomos de S (azufre) que hay en el compuesto.
Repetimos el proceso con cada uno de los otros elementos.
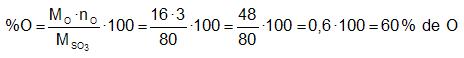
donde nO es el número de átomos de O (oxígeno) que hay en el compuesto.
Para comprobar si los cálculos son correctos debemos sumar todos los porcentajes. La suma debe ser el 100% (admitimos ±0,1% por errores de decimales al dividir). En nuestro ejemplo, si sumamos los dos porcentajes nos da el 100%.
Importante. Conviene calcular todos los porcentajes, incluido el último; o sea, no calcules el último restando a 100% la suma de los otros. ¿Por qué? Para comprobar si cometes errores, si lo haces restando nuca sabrás si has cometido errores al calcular alguno de los porcentajes dado que la suma siempre saldría el cien por cien.
Determinación de la fórmula empírica.
Para determinar la fórmula empírica debemos conocer el porcentaje en peso de cada elemento en el compuesto y las masas atómicas de cada uno de ellos. Por ejemplo, supongamos que tenemos 40,00% de C, 6,67% de H y 53,33% de O. Las masas atómicas son MC=12u, MH=1u, MO=16u.
Seguiremos los siguientes pasos:
Consideramos 100 g de compuesto: el porcentaje de cada uno serán los gramos de cada elemento que hay en 100 g de compuesto. Siguiendo el ejemplo, tendremos 40,00 g de C, 6,67 g de H y 53,33 g de O.
Dividimos cada masa por la masa atómica del elemento correspondiente:
C: 40,00 / 12 = 3,33
H: 6,67 / 1 = 6,67
O: 53,33 / 16 = 3,33
Ahora dividimos cada uno de los resultados anteriores por el más pequeño de ellos, en este caso por 3,33:
C: 3,33 / 3,33 = 1
H: 6,67 / 3,33 = 2
O: 3,33 / 3,33 = 1
El resultado debe ser un número entero, los números enteros más pequeños, y la fórmula empírica sería C1H2O1, quitando los unos quedaría CH2O como fórmula empírica.
Determinación de la fórmula molecular.
Para conocer la fórmula molecular, debemos tener los mismos datos de partida que para la fórmula empírica (porcentajes y masas atómica) y, además, la masa molecular del compuesto (en nuestro ejemplo sería 180 u).
Seguiríamos los mismos cuatro pasos del caso anterior para determinar la fórmula empírica y continuaríamos de la siguiente forma:
Calculamos la masa molecular con la fórmula empírica. En nuestro ejemplo sería sobre el compuesto de fórmula empírica CH2O:
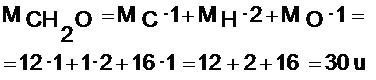
Ahora dividimos la masa molecular real que nos han dado, entre la masa calculada con la fórmula empírica:
masa molecular / masa fórmula empírica = 180 / 30 = 6
El resultado nos indica el número de veces que la fórmula molecular será la fórmula empírica. Para escribir la fórmula molecular multiplicaremos cada subíndice de la fórmula empírica por el número obtenido de la división:
C1·6 H2·6 O1·6 > C6H12O6
Por tanto, la fórmula molecular será en nuestro caso C6H12O6
Nota: Diferencia entre fórmula empírica y fórmula molecular
|
Pedro Martínez /
www.educamix.com
/
educamix@telefonica.net
|