Reacciones químicas y
cálculos estequiométricos.
Reacciones químicas que debes estudiar de forma prioritaria este curso
·
Reacciones de síntesis
también llamadas de composición. Son aquellas en las que dos o más sustancias
se unen para formar una nueva.
CaO
+ H2O à
Ca(OH)2
N2
+ 3 H2
à
2 NH3
·
Reacciones de
descomposición también llamadas de análisis. Son aquellas en las que una
sustancia se descompone en otras de estructura más simple.
CaCO3
à
CaO +
CO2
·
Reacciones de
sustitución también llamadas de desplazamiento. Son aquellas en las que un
elemento que forma parte de un compuesto es desplazado y sustituido por otro
Zn
+ H2SO4
à
ZnSO4 +
H2
2
HCl +
Fe à
FeCl2 +
H2
·
Reacciones de doble
sustitución también llamadas de doble desplazamiento. Son aquellas en las que
los compuestos intercambian entre sí algún elemento químico, transformándose
en otros dos compuestos distintos.
AgNO3
+ HCl à
AgCl +
HNO3
·
Reacciones de
oxidación. Son aquellas en las que se combina una sustancia con el oxígeno.
Actualmente se denominan reacciones redox y no es necesario que siempre
intervenga el oxígeno. En las reacciones de oxidación existe una variación en
el número de oxidación de un par de elementos (uno aumenta su número de
oxidación y otro lo disminuye)
4
Fe +
3 O2 à
2 Fe2O3
2
Fe +
3 Cl2
à
2 FeCl2
Fe
+ S
à
FeS
·
Reacciones de
combustión. Son aquellas en las que se
combina el oxígeno y un material oxidable, viene acompañada de desprendimiento de energía y
habitualmente se manifiesta por incandescencia o llama. Por tanto, es un tipo de
reacción de oxidación en la que suele intervenir un compuesto de carbono.
C
+ O2 à
CO2
CH4
+ 2 O2
à
CO2 +
2 H2O
2
C2H2 +
5 O2 à
4 CO2 + 2 H2O
Reacciones
químicas que debes estudiar de forma prioritaria este curso.
A)
Metales + O2 (Metales:
Na, Mg, Fe, Zn, Al) à
Óxidos del metal (Na2O, MgO, Fe2O3, FeO, ZnO,
Al2O3)
B)
No metales + O2 (No
metales: C, S, H) à
óxidos no metálicos (CO2, CO, SO2, H2O)
C)
Combustiones de materiales orgánicos en presencia de oxígeno.
Compuesto
orgánico (Metano, Etano, Propano, Butano, Etanol, Acetileno) + O2 à
CO2 + H2O
Nota:
-
Metano : CH4
-
Etano: CH3-CH3
(C2H6)
-
Propano: CH3-CH2-CH3
(C3H8)
-
Butano: CH3-CH2-CH2-CH3
(C4H10)
-
Etanol (alcohol etílico):
CH3-CH2OH
(C2H6O)
-
Acetileno (etino):
CH ≡ CH (C2H2)
D)
Ácidos con metales:
Ácidos
(HCl, H2SO4, HNO3) + Metales (Mg, Zn)
à
à
Sal del ácido (MgCl2, MgSO4, Mg(NO3)2,
ZnCl2, ZnSO4, Zn(NO3)2)
+ Hidrógeno (H2)
Nota:
-
HCl
à
ácido clorhídrico
-
H2SO4
à
ácido sulfúrico
-
HNO3 à
ácido nítrico
-
MgCl2 à
cloruro de magnesio
-
MgSO4 à
sulfato de magnesio
-
Mg(NO3)2
à
nitrato de magnesio
-
ZnCl2 à
cloruro de cinc
-
ZnSO4 à
sulfato de cinc
-
Zn(NO3)2
à
nitrato de cinc
a.
Calcula el número de moles del dato:
![]()
b.
Calcula el número de moles de la sustancia incógnita utilizando la
relación estequiométrica entre el dato y la incógnita:
![]()
c.
Calcula la masa en gramos del dato:
![]()
Ejemplo:
Tengamos 10
kg de aluminio que se oxidan en presencia de oxígeno. Calcula la cantidad de óxido
de aluminio que se forma. Datos: MAl = 27 u ,
MO = 16 u
Al
+ O2
à
Al2O3
4
Al + 3 O2
à
2 Al2O3
![]()
![]()
![]()
a.
Calcula el número de moles del Al:
![]()
b.
Calcula el número de moles de Al2O3 utilizando la
relación estequiométrica entre Al y Al2O3:
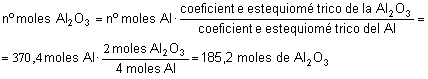
c.
Calcula la masa en gramos del Al2O3:
![]()
|
|